
De acuerdo con un periodista de la prestigiosa revista Science (29 de noviembre de 2013): “El colesterol (…) cuando es metabolizado por el cuerpo (…) se convierte en una potente molécula, similar al estrógeno, que estimula el crecimiento del cáncer de seno en los ratones y tal vez en las personas. Esa es la conclusión de (…) estudios que arrojan nueva luz sobre el vínculo entre la obesidad y el cáncer”. Y este periodista continúa citando a un científico, altamente calificado en Boston, que dice: “Nadie había pensado en ello antes. Se plantea una nueva estrategia potencial”.
El autor se refiere a los hallazgos de dos grupos de investigación; uno, en la Escuela de Medicina de la Universidad de Duke1, el otro en el Centro Médico de la Universidad del Sudoeste de Texas, en Dallas2.
¡No podría haber esperado un mejor ejemplo de cómo la investigación médica va por tan mal camino! Esto ilustra maravillosamente el tema principal de mi nuevo libro, Whole (2013).
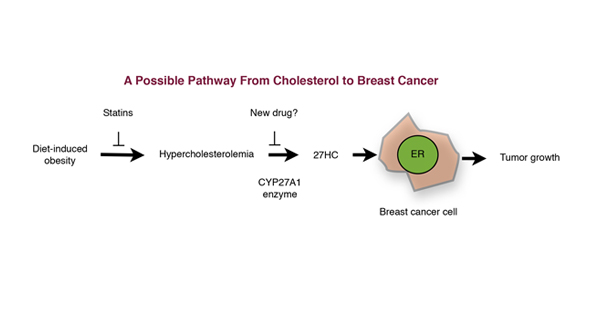
La ruta que resume este nuevo hallazgo se muestra en el gráfico (redibujado como en Science). Principalmente, muestra cómo el colesterol sérico alto (hipercolesterolemia) se conecta con el cáncer de seno. El colesterol es metabolizado por una enzima en el tejido mamario, CYP27A1, para producir 27HC (27- dehidrocolesterol), que tiene una actividad parecida a la del estrógeno y que aumenta el crecimiento del cáncer de seno en una placa de Petri, en el laboratorio. También encontraron que las actividades elevadas de la enzima CYP27A1 en el cáncer de seno humano estaban asociadas con tumores que eran más agresivos.
En resumen, los altos niveles de colesterol sérico, los altos niveles de enzimas CYP27A1 y más del 27HC, similar al estrógeno, hacen que los tumores de seno sean más agresivos —algo que “nadie había pensado antes”—. Esto no es completamente cierto, porque omite o descarta pruebas altamente relacionadas que cambian sustancialmente su conclusión.
Nuestros hallazgos en la China rural mostraron, hace más de 20 años, que los altos niveles de colesterol sérico estaban asociados de forma muy significativa con cánceres como un grupo (incluyendo el cáncer de seno)3 y, además, que el cáncer de seno estaba asociado con la actividad del estrógeno circulante45. Aproximadamente 20 a 25 años antes de eso, estábamos investigando extensivamente la enzima multi-variante CYP27A1, activadora de carcinógenos (conocida entonces como oxidasa de función mixta)6 y que mostró ser altamente sensible a los incrementos en el consumo de caseína (proteína)7 y otros factores nutricionales8.
El alto consumo de proteínas aumentó rápida y sustancialmente los niveles de enzimas, y eso resultó en más cáncer (esto fue publicado ampliamente en estudios de mi grupo revisados por expertos). Además, algunos de mis colegas demostraron un alto consumo de proteínas, altos niveles de estrógeno y alto desarrollo del cáncer de seno en estudios con animales9, 10. Estos estudios, en conjunto, dieron lugar a docenas (si no cientos) de artículos de investigación revisados por expertos, que mostraron un efecto notorio de la proteína de origen animal al alimentar esta actividad enzimática, en el aumento del colesterol sérico, en el aumento del estrógeno circulante, en una asociación impresionante con la incidencia del cáncer de seno, así como en varios otros eventos alimenticios y metabólicos asociados con el cáncer de seno.
Sobre esta base fue que yo, y muchos otros, hemos conocido acerca de la relación entre el cáncer de seno y la alimentación. En nuestro libro, El Estudio de China (p. 159-161), presentamos un esquema aproximado de este vínculo. Nuestra investigación apoyó especialmente la idea de que el aumento del consumo de proteínas de origen animal puso en marcha, a toda velocidad, toda esta serie de eventos, lo que ayudó a explicar cómo el cáncer de seno es una enfermedad determinada por la alimentación (por una dieta alta en comidas de origen animal).
Aunque el esquema de resumen que se muestra al comienzo reconoce una conexión de la alimentación separada del cáncer de seno (pero superficialmente la revelan como “obesidad relacionada con la dieta” —¡la obesidad no es una causa, es un resultado!), la ignoran y señalan cómo sería posible desarrollar un fármaco para bloquear la enzima CYP27A1.
En este escenario, se enfocan en bloquear una actividad enzimática individual incrustada dentro de una red muy compleja de eventos metabólicos y reacciones catalizadas por enzimas, un proceso que, si se continúa, da lugar a efectos secundarios “accidentales”. Esto permite que la gente continúe usando una dieta que eleva el colesterol sérico, eleva esta actividad enzimática, eleva la producción de 27HC y eleva el crecimiento del tumor —entre otros innumerables impactos en la salud—. Pero, ¿por qué no simplemente animar a la gente a cambiar su alimentación y permitir que la naturaleza controle estos eventos de manera mucho más eficaz, segura y económica, produciendo así el efecto deseado sin todos los efectos secundarios?
Este es un ejemplo de cómo funciona habitualmente la investigación médica, enfocándose en un evento a la vez, enterrada dentro de un sistema inmensamente complejo. El desarrollo de medicamentos individuales —potencialmente peligrosos—, dirigidos a los tejidos para bloquear vías individuales, habitualmente deja de lado el control de la verdadera culpable: la alimentación. ¡Esta estrategia es tan débil, tan desacertada y tan centrada en la generación de riqueza para los pocos sobre la salud de los muchos! ¡Vergonzoso!
Tengo una última pregunta: ¿Por qué la investigación sobre la relación de la alimentación con el bienestar humano, especialmente una alimentación basada en plantas sin procesar 11, ha sido tan descuidada, ignorada e, incluso a veces, tan denigrada? He visto muchas formas de este rechazo desde hace muchos años (mucho de él de primera mano) y he aprendido que tales reacciones han existido durante décadas, incluso siglos, antes de nuestra época.
Copyright 2026 Centro de Estudios en Nutrición. Todos los derechos reservados.